Gdyby nie tlen...
Procesy metaboliczne dzielimy na dwie kategorie, mianowicie katabolizm i anabolizm. Na katabolizm składają się reakcje prowadzące do rozkładu związków organicznych (cukrów, tłuszczy, białek, itd.) i podstawowym ich zadaniem jest wytworzenie energii niezbędnej m.in. dla procesów anabolicznych, czyli syntezy związków organicznych koniecznych dla życia i funkcjonowania organizmu. Dla większości organizmów żyjących na Ziemi niezbędnym elementem katabolizmu jest tlen.
Obecnie tlen stanowi około 21% składu powietrza. Jego pojawienie się 2,5 miliarda lat temu było momentem, który stał się punktem zwrotnym w dziejach Ziemi. Do tego czasu organizmy żywe pozyskiwały energię z procesów katabolicznych bez udziału tlenu. Jak kolosalna jest ta różnica, obrazuje przykład: rozkład
1 cząsteczki glukozy dostarcza komórce około 14 kcal w warunkach beztlenowych i około 270 kcal w warunkach tlenowych. Finalną reakcją katabolizmu jest czteroelektronowa redukcja cząsteczki tlenu prowadząca do powstania dwóch cząsteczek wody. Badania dotyczące metabolicznej roli tlenu trwają praktycznie od połowy XX wieku i to dzięki nim wiemy dzisiaj, że cząsteczka tlenu może przyłączyć również jeden, dwa lub trzy elektrony, co prowadzi do powstania reaktywnych form tlenu. Ocenia się, że średnio około 4% tlenu ulega w komórkach przekształceniu do reaktywnych form tlenu. Charakteryzują się one dużą aktywnością chemiczną, dzięki czemu łatwo wchodzą w reakcje z obecnymi w organizmie cząsteczkami lipidów, białek, kwasów nukleinowych (DNA, RNA), węglowodanów, aminokwasów, prowadząc do zmian ich struktury i funkcji, a w konsekwencji nawet do śmierci komórek. Wiadomo też, że reaktywne formy tlenu przyspieszają procesy starzenia i przyczyniają się do rozwoju wielu chorób, w tym: układu krążenia, nowotworów czy chorób neurologicznych. Cóż, gdyby nie było tlenu, nie byłoby również reaktywnych form tlenu. Wydaje się więc, że reaktywne formy tlenu to cena, jaką tlen każe sobie płacić za swoją skuteczną, efektywną i niezwykle wydajną pracę w procesie produkcji niezbędnej do życia energii. Zagrożenia dla struktury i funkcji komórek, jakie niosą ze sobą reaktywne formy tlenu nie mogły pozostać bez ewolucyjnej odpowiedzi. Pojawiła się niebezpieczna mafia reaktywnych form tlenu – i komórki musiały zwerbować zespół strażników ochrony osobistej – komentuje profesor Grzegorz Bartosz z Uniwersytetu Łódzkiego w swojej książce Druga twarz tlenu. Tak więc, w każdym aerobowym organizmie istnieje Biuro Ochrony Komórki, którym dowodzi GLUTATION.
POLECAMY
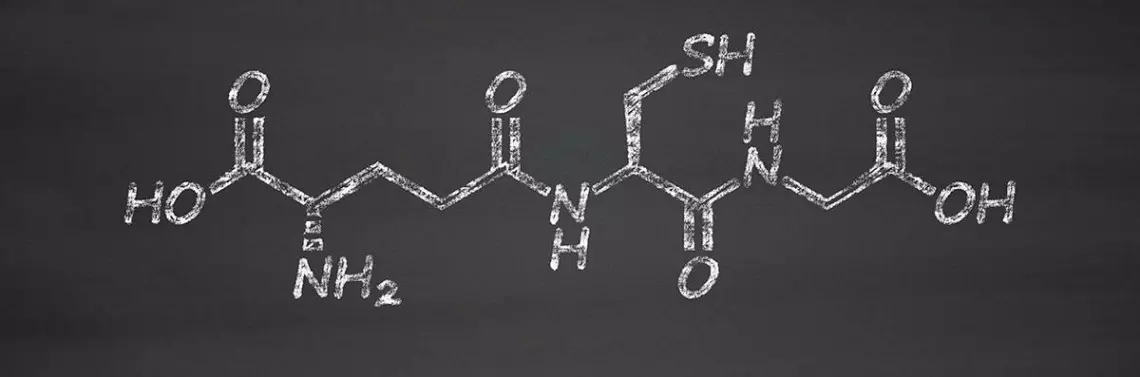
Kocham siarkę
W 1888 roku francuski lekarz Joseph de Rey-Pailhade odkrył w komórkach drożdży istnienie substancji, która chętnie reaguje z siarką elementarną, tworząc siarkowodór. Substancję t...
Pozostałe 90% treści dostępne jest tylko dla Prenumeratorów
- 6 wydań czasopisma "Naturoterapia w praktyce" w roku + wydania specjalne
- Nielimitowany dostęp do całego archiwum czasopisma
- Dodatkowe artykuły i filmy
- ...i wiele więcej!