W Indiach od około 1000 r. p.n.e. rośliny te znalazły zastosowanie zarówno medyczne jako środki przeciwbólowe, przeciwdrgawkowe, znieczulające, przeciwzapalne i biobójcze, jak i do celów rekreacyjnych. Do medycyny zachodniej rośliny te zostały wprowadzone w XIX w. głównie za sprawą Williama B. O’Shoughnessy – irlandzkiego lekarza oraz Jacquesa Josepha Moreau – francuskiego psychiatry. O’Shoughnessy po raz pierwszy spotkał się z konopiami pracując jako lekarz w Indiach. Wyniki badań O’Shoughnessy’ego, Moreau i innych lekarzy sprawiły, że konopie szybko rozpowszechniły się w Europie, a następnie w Północnej Ameryce. Kulminacyjny moment wykorzystania marihuany i innych przetworów konopnych w celach medycznych przypadł na koniec XIX i początek XX w. Produkty na bazie konopi sprzedawane były przez liczne koncerny farmaceutyczne np. Merck (Niemcy), Burroughs Wellcome (Anglia), Bristol-Meyers Squibb (Stany Zjednoczone), Parke-Davis (Stany Zjednoczone), czy Eli Lilly (Stany Zjednoczone). Wskazania medyczne dotyczące preparatów na bazie konopi zostały w 1924 roku podsumowane w Sajous’s Analytic Cyclopedia of Practical Medicine i odnosiły się do ich właściwości jako leków uspokajających, nasennych, przeciwbólowych oraz poprawiających apetyt18, 35, 56.
W 1937 roku w Stanach Zjednoczonych uchwalono ustawę podatkową dotyczącą marihuany, co praktycznie całkowicie wyeliminowało wykorzystanie konopi w celach leczniczych. Na skutek restrykcyjnych przepisów zakazujących hodowli, posiadania i konsumpcji konopi, a także w wyniku zmiennego składu preparatów roślinnych, krótkiego okresu trwałości oraz nieprzewidywalności relacji dawka – efekt, marihuanę usunięto w 1932 r. z Farmakopei Brytyjskiej, a w 1941 r. z Farmakopei Stanów Zjednoczonych29, 42, 45.
POLECAMY
R e k l a m a
Substancje czynne
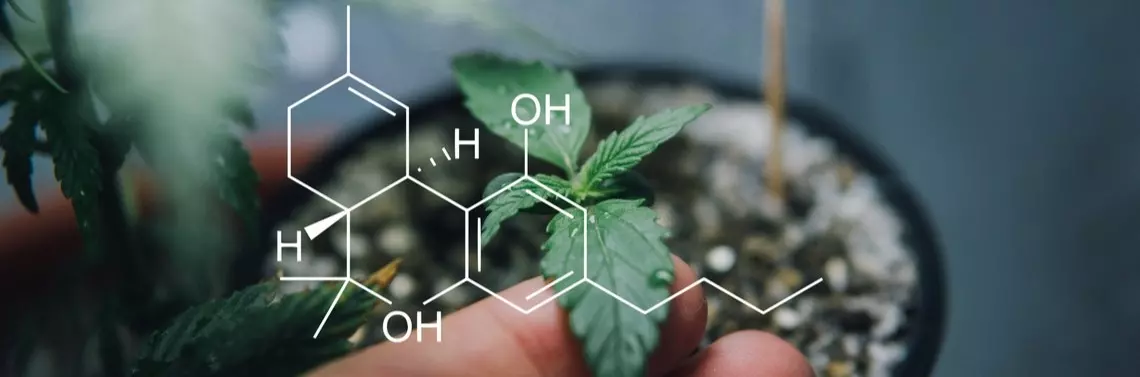
Konopie są roślinami dwupiennymi, tzn. występują osobniki mające kwiatostany wyłącznie męskie oraz osobniki mające kwiatostany wyłącznie żeńskie (chociaż znane są przypadki roślin jednopiennych). Produkują > 500 różnych metabolitów wtórnych, z których wiele wykazuje aktywność biologiczną1, 19. Proporcje między zawartością poszczególnych substancji są zmienne i zależą od gleby, czynników klimatycznych oraz odmiany rośliny46. Dwoma najintensywniej badanymi pod względem farmakologicznych właściwości związkami aktywnymi konopi są Δ9-tetrahydrokannabinol (THC) oraz kannabidiol (CBD), zaliczane do liczącej ponad 100 związków grupy, zwanej kannabinoidami. Hodowane komercyjnie odmiany konopi można podzielić na trzy podstawowe chemotypy różniące się stosunkiem THC/CBD. Chemotyp I zawierający duże ilości THC (> 85% wszystkich wyekstrahowanych fitokannabinoidów), chemotyp II, pośredni z przewagą CBD, ale o względnie dużej zawartości THC i chemotyp III bogaty w CBD (> 85% wszystkich wyekstrahowanych fitokannabinoidów)41, 49.
Oprócz THC i CBD ważną grupę kannabinoidów produkowanych przez Cannabis sativa L. stanowią: kannabinol (CBN), kannabichromen (CBC), ∆8-THC, kannabigerol (CBG), kannabiwarin (CBV), kannabicyklol (CBL). Dobierając odpowiednie warunki hodowli można wpłynąć na zawartość niektórych substancji47. Największa ilość kannabinoidów znajduje się w szczytowych kwitnących częściach rośliny oraz w młodych, niewielkich listkach otaczających kwiatostany. Do celów medycznych mają zastosowanie rośliny żeńskie, o znacznie większej zawartości substancji czynnych. Produktami uzyskanymi na bazie konopi powszechnie stosowanymi w celach rekreacyjnych i medycznych są: marihuana, haszysz i olej haszyszowy. Marihuana to wysuszone, a następnie rozdrobnione liście i kwiatostany górnych pędów konopi. Występuje najczęściej w postaci krajanki lub drobno sproszkowanych fragmentów roślinnych. To produkt praktycznie niewymagający dodatkowej obróbki. Haszysz jest żywicą z ziela Cannabis, wytwarzaną przez roślinę w okresie dojrzewania – kwitnienia i owocowania. Olej haszyszowy jest ciekłym ekstraktem materiału roślinnego lub żywicy otrzymanym za pomocą rozpuszczalników organicznych, takich jak alkohol, benzyna czy eter naftowy47.
Skład dymu
Palenie marihuany z medycznego punktu widzenia nie jest dopuszczalną metodą dostarczania związków aktywnych Cannabis sativa L. do organizmu. Oprócz kannabinoidów odpowiedzialnych za jego pozytywne działanie terapeutyczne, dym powstały w wyniku palenia konopi zawiera wiele takich samych składników, jak dym tytoniowy. Niektóre z nich, takie jak 4-aminobifenyl, arsen, benzen, kadm, formaldehyd i ołów, są znanymi czynnikami rakotwórczymi dla ludzi. Oprócz tego, palenie konopi przyczynia się do powstania substancji toksycznych, takich jak amoniak, tlenek węgla, cyjanowodór i tar. Chociaż w testach mutagenności skropliny dymu marihuany charakteryzują się porównywalną lub nawet nieco mniejszą mutagennością niż kondensaty dymu tytoniowego, palenie marihuany jest powiązane z wyższym poziomem karboksyhemoglobiny, smoły wdychanej i smoły zatrzymanej w płucach w porównaniu z paleniem papierosów z końcówkami filtrującymi, choć może to wynikać z zaobserwowanych różnic...
Pozostałe 90% treści dostępne jest tylko dla Prenumeratorów
- 6 wydań czasopisma "Naturoterapia w praktyce" w roku + wydania specjalne
- Nielimitowany dostęp do całego archiwum czasopisma
- Dodatkowe artykuły i filmy
- ...i wiele więcej!